► Introducción y objetivos
El dolor crónico es un cuadro frecuente y, según lo estimado, la quinta parte de los pacientes que lo sufren presenta dolor neuropático. La ausencia de tratamientos eficaces es un factor que contribuye con la prevalencia elevada de dolor crónico y neuropático. La administración de tratamientos que actúan sobre los mecanismos responsables del dolor es más eficaz en comparación con la administración de tratamientos dirigidos a una enfermedad determinada. No obstante, conocer los mecanismos responsables de los síntomas neuropáticos no resulta sencillo.
La presente revisión se llevó a cabo con el objetivo de evaluar los mecanismos responsables de la aparición de dolor neuropático y sus consecuencias clínicas.
► Fisiología y clasificación

Existen diferentes tipos de dolor vinculados con mecanismos neurobiológicos y fisiopatológicos específicos. El dolor puede dividirse en neuropático y nociceptivo. A su vez, el dolor nociceptivo puede clasificarse como somático o visceral. El dolor somático crónico en general se encuentra bien localizado y resulta de procesos degenerativos. Esto se debe a que la concentración de nociceptores en los tejidos somáticos es elevada. En cambio, los órganos internos responden a estímulos diferentes como la isquemia, la inflamación o la oclusión del flujo y la consiguiente distensión capsular. En este caso, el dolor no puede localizarse con precisión y genera cuadros como la angina de pecho.
El dolor neuropático resulta del daño o la disfunción del sistema somatosensorial. Este tipo de dolor puede ser central, por ejemplo en presencia de daño de la médula espinal. De acuerdo con la información disponible, la prevalencia estimada de dolor neuropático aumentó significativamente durante la última década. Su presencia tiene consecuencias negativas significativas y más desfavorables sobre la calidad de vida en comparación con el dolor nociceptivo.
De todos modos, debe considerarse que el dolor es un cuadro que resulta de diferentes procesos neuropsicológicos, contextuales, psicológicos y socioculturales. Dado que el dolor es una experiencia multidimensional, los factores psicosociales pueden predecir su cronificación luego de un episodio agudo. Además, debe considerarse que el contexto en el cual aparece el estímulo doloroso influye sobre la percepción del dolor y la respuesta al tratamiento.
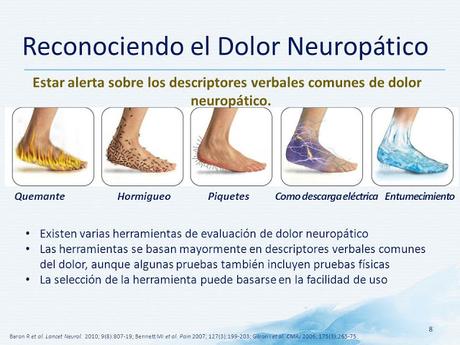
¿Qué son alodinia e hiperalgesia?
La sensibilización periférica es un estado de hiperexcitabilidad generado por la inflamación y los procesos de reparación posteriores a una lesión. Cuando persiste la nocicepción, se observan cambios neuronales duraderos en los aferentes primarios. La sensibilización periférica es favorecida por la acción de los mediadores inflamatorios, como la sustancia P, liberados en los terminales nociceptivos. Estos mediadores generan un aumento de la permeabilidad vascular, edema localizado y liberación de citoquinas y otros factores que sensibilizan y excitan a los nociceptores. Dada la existencia de numerosas sustancias que pueden sensibilizar a los nociceptores, no existe un tratamiento farmacológico eficaz universal para los pacientes con dolor generado por estos mecanismos.
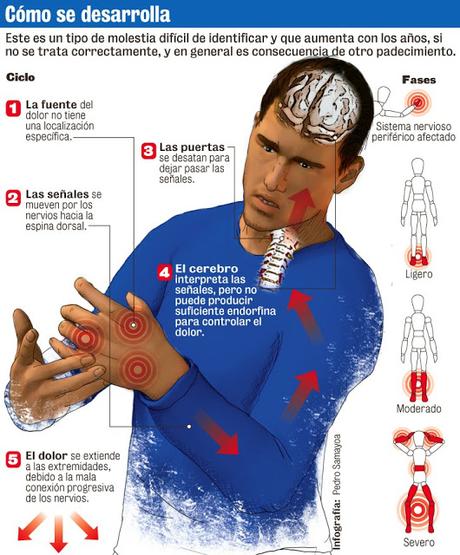
El dolor espontáneo puede ser provocado por descargas ectópicas originadas en los ganglios de la raíz dorsal, en el nervio dañado o en fibras nerviosas sanas adyacentes. En este último caso tiene lugar un mecanismo de transmisión efáptica.
La alodinia, es decir el dolor generado por estímulos que no lo provocarían en condiciones normales, puede deberse a la disminución del umbral de estimulación nerviosa y se clasifica como mecánica o térmica.
En cambio, la hiperalgesia se define como una percepción dolorosa exagerada resultante del daño de los nervios periféricos y puede ser primaria o secundaria. La hiperalgesia primaria tiene lugar ante la sensibilización de los nociceptores periféricos ubicados en un tejido dañado, en tanto que la hiperalgesia secundaria resulta de la sensibilización central y se observa en tejidos adyacentes no dañados.
El daño nervioso genera la expresión de determinados genes que modifican la función nerviosa y pueden afectar la excitabilidad y las características celulares.
La descarga espontánea de las fibras nerviosas dañadas puede asociarse con un aumento de la expresión de los canales de sodio en los ganglios de la raíz dorsal y en la región adyacente al sitio axonal dañado. La proliferación de los canales de sodio heterotópicos puede disminuir el umbral de estimulación y generar descargas ectópicas y dolor espontáneo. Además, este mecanismo puede favorecer la sensibilización central y generar alodinia. De hecho, la carbamazepina y otros fármacos empleados como complemento del tratamiento de los pacientes con dolor bloquean los canales de sodio, aunque la falta de selectividad por el subtipo de canal implicado en el dolor se asocia con índices terapéuticos bajos y efectos adversos considerables.
También se destaca la participación de ciertos canales de calcio y potasio en la aparición de dolor neuropático. En coincidencia, los gabapentinoides son drogas de primera línea para el tratamiento de los pacientes con dolor neuropático, que actúan sobre los canales de calcio dependientes del voltaje.
El daño nervioso genera la expresión de determinados genes que modifican la función nerviosa y pueden afectar la excitabilidad y las características celulares. En consecuencia, se observa una modificación fenotípica que podría generar dolor ante la exposición a estímulos típicamente inocuos. Finalmente, el daño de un nervio sensitivo produce cambios atróficos que pueden resultar en la disminución del tamaño y la muerte celular. Así, se observa una reducción de la densidad de los nociceptores intraepidérmicos, lo cual puede generar una disminución o un aumento de la sensación de dolor, con la consiguiente hiperalgesia. Este cuadro se denomina dolor por desaferentación.
El dolor puede ser mantenido o acentuado debido a la presencia de anormalidades en el sistema nervioso simpático. Esto implica una interacción entre los sistemas autonómico y somatosensorial, que incluye la expresión de receptores alfa adrenérgicos en las fibras sensitivas aferentes primarias y la afectación de la oxigenación y la nutrición vinculada con la vasoconstricción, entre otros mecanismos. Desde el punto de vista clínico, el dolor mantenido por mecanismos simpáticos puede manifestarse con cambios de temperatura o coloración de una extremidad, sudoración y atrofia.
La plasticidad sináptica manifestada como sumatoria espacial y temporal es un componente espinal importante del dolor neuropático. Los campos receptivos expandidos, las neuronas de segundo orden y el aumento de la excitabilidad neuronal de las vías nociceptivas ascendentes también intervienen en la aparición de este tipo de dolor. Los cambios neuroplásticos mencionados tienen lugar en las vías nociceptivas espinales y cerebrales.
La inhibición y la facilitación descendentes convergen en las neuronas del asta dorsal y modulan las señales nociceptivas generadas por el daño nervioso. A nivel celular, la transmisión de las señales nociceptivas es modulada por elementos intracelulares y extracelulares, como los canales iónicos, los receptores ionotrópicos y metabotrópicos, los factores de crecimiento, los moduladores intracelulares, los factores transcripcionales y las citoquinas inflamatorias liberadas por las células gliales activadas.
El daño de los nervios periféricos aumenta la excitabilidad neuronal espinal mediante la activación de los receptores glutamatérgicos e induce una disminución de los transportadores espinales de glutamato implicados en el mantenimiento de la homeostasis del neurotransmisor. Esto resulta en el aumento de la disponibilidad regional de glutamato y en la activación de los receptores ionotrópicos y metabotrópicos, con la consiguiente reducción del umbral de activación y el aumento de la excitabilidad neuronal y de la neurotoxicidad.
En cuanto al papel de la activación glial y las citoquinas en presencia de dolor neuropático, es sabido que el daño nervioso aumenta la síntesis periférica y central de citoquinas proinflamatorias, como la interleuquina 1 beta, la interleuquina 6 y el factor de necrosis tumoral alfa. Las citoquinas intervienen tanto en la respuesta inflamatoria asociada con el daño nervioso como en la sensibilización central, la aparición de alodinia e hiperalgesia y la formación del neuroma. Los procesos mencionados se vinculan con la proliferación de las células gliales en el ganglio de la raíz dorsal y la médula espinal luego del daño nervioso.
► Mecanismos supraespinales
Los pacientes con dolor crónico presentan características cerebrales particulares vinculadas con el metabolismo y la concentración de neurotransmisores en regiones como el tálamo y la corteza cingulada. El tipo de dolor influye sobre dichas características. En caso de dolor neuropático, el daño se asocia y se correlaciona con la reorganización cortical. Según lo hallado en estudios preclínicos, el daño nervioso genera una modificación de la expresión genética.
Esto permite observar la contribución de los cambios de la transducción de señales y de la neuroprotección y la apoptosis con la aparición de dolor neuropático. Además, los cambios supraespinales observados en caso de dolor neuropático permitirían explicar la aparición de trastornos del estado de ánimo de estos pacientes. Finalmente, se verificó que los individuos con dolor crónico tienen un volumen menor de sustancia gris con los sujetos sin dolor. Esto puede modificarse en cierta medida mediante el tratamiento analgésico apropiado.
La transmisión de un estímulo nociceptivo a los centros corticales superiores es seguida por la activación de las neuronas inhibitorias que disminuyen el dolor. Esto se asocia con un aumento de la liberación de los neurotransmisores GABA y glicina a nivel espinal. La lesión resulta en la pérdida de los mecanismos inhibitorios mencionados. Esto provoca alodinia e hiperalgesia.
Además, la lesión nerviosa causa una disminución de la expresión de receptores opioides tipo mu en los ganglios de la raíz dorsal y una reducción de la respuesta de las neuronas espinales a los opioides. Por el contrario, la inflamación nerviosa puede aumentar la cantidad y la afinidad de los receptores opioides y la eficacia analgésica de los opioides. Por este motivo, los pacientes con dolor neuropático crónico requieren dosis más elevadas de estas sustancias que aquellos con dolor nociceptivo.
La inhibición descendente es uno de los factores determinantes del modo de experimentación del dolor. La modulación descendente puede ser inhibidora o facilitadora y el equilibrio entre ambos mecanismos depende del contexto, las emociones, la conducta y la enfermedad que presenta el paciente, entre otros factores. Este hallazgo coincide con lo informado en otros estudios y permite explicar la asociación entre las expectativas positivas y los resultados terapéuticos favorables en sujetos con dolor.
La modulación descendente de las señales nociceptivas es ejercida por vías que se originan en la sustancia gris periacueductal, el locus coeruleus, el giro cingulado anterior, la amígdala y el hipotálamo. La lesión nerviosa disminuye la inhibición normal del dolor al reducir el tono noradrenérgico y facilitar la modulación serotoninérgica descendente. Además, dichas vías afectan tanto el dolor como el estado de ánimo y el sueño. Esto coincide con la comorbilidad significativa entre el dolor, la depresión, la ansiedad y las alteraciones del sueño y con los beneficios de los antidepresivos tricíclicos para mejorar tanto el dolor como el estado anímico.
► Dolor neuropático y dolor nociceptivo
La aparición de dolor nociceptivo requiere la conversión de una señal no eléctrica en una señal electroquímica, en tanto que el dolor neuropático se asocia con la estimulación directa de un nervio. El pronóstico de ambos tipos de dolor es diferente ya que los pacientes con dolor nociceptivo generalmente logran recuperarse. En cambio, los individuos con una lesión nerviosa grave frecuentemente presentan dolor persistente. A pesar de las diferencias mencionadas, algunos expertos consideran que ambos tipos de dolor forman parte de un continuo.
En coincidencia, se informó que existen formas de dolor neuropático que no se asocian con daño nervioso. Ambos tipos de dolor coinciden en cuanto a los neurotransmisores, los neuropéptidos, las citoquinas y las enzimas implicados en su aparición y pueden mejorar ante la administración del mismo tipo de fármacos. Lo antedicho permite sugerir que el dolor nociceptivo y el dolor neuropático forman parte de un mismo continuo.
El dolor neuropático puede resultar del daño del sistema nervioso central o periférico y de los cambios maladaptativos de las neuronas que integran la vía de la nocicepción. La aparición de dolor neuropático se vincula con mecanismos que coinciden, en cierta medida, con los implicados en la aparición de dolor no neuropático y otras enfermedades neurológicas. Tanto los mecanismos que intervienen en la aparición de dolor como el componente afectivo motivacional del dolor crónico aumentan la resistencia al tratamiento. En consecuencia, es necesario efectuar estudios adicionales con el fin de implementar estrategias terapéuticas alternativas y contar con fundamentos para la práctica clínica.



