Se debe sospecha demencia ante un paciente que presenta deterioro de la funciones mentales superiores (perdida de memoria con o sin afectación del lenguaje, y alteraciones en pensamiento abstracto y /o razonamiento), sin alteración del nivel de consciencia.
La EA pasa por diferentes fases:
- Etapa inicial, con una sintomatología leve, en la que el paciente mantiene su autonomía y sólo necesita supervisión cuando trata de desarrollar tareas complejas. El síntoma más común es el paulatino deterioro de la memoria de eventos recientes. También es frecuente que empiece a surgir una típica desorientación espacial, que ira increscendo. Del mismo modo surgen otros síntomas como disminución en la concentración, cambios de humor, síntomas de depresión como apatía, pérdida de iniciativa y falta de interés. Junto a ellos, puede aparecer inquietud y ansiedad, síntomas que muy comúnmente se presentan al atardecer o durante la noche. Por otra parte, el lenguaje, las habilidades motoras y la percepción se mantienen conservadas, siendo el paciente capaz de mantener una conversación, comprendiendo bien y utilizando gestos, entonaciones y expresiones dentro de la normalidad. Esta primera etapa tiene una duración aproximada de 2 a 5 años.
- Etapa intermedia, con síntomas de gravedad moderada, en la que el paciente depende de un cuidador para realizar las tareas cotidianas. El deterioro de la memoria es más acentuado y se acompaña de afasia, apraxia y agnosia (triple A o triada afasia-apraxia-agnosia). -Por afasia se entiende dificultad en el lenguaje, cambiando unas palabras por otras, como por ejemplo una "llave" por un "bolígrafo". La apraxia es la dificultad que presenta el paciente para llevar a cabo funciones aprendidas, como por ejemplo apraxia para vestirse, uso de los cubiertos, calculo matemático, etc. La agnosia consiste en una pérdida de la capacidad para reconocer a personas a las que conoce- .Durante esta etapa, las aficiones que tenía el paciente, las actividades sociales, de ocio y de recreo pierden totalmente su valor, mostrándose aburrido, apático o somnoliento y puede apreciarse cierto grado de Parkinson. También pueden aparecer algunos síntomas de tipo psicótico, como alucinaciones auditivas y visuales, ideación delirante e incluso agitación y agresividad. Este estadío tiene una duración aproximada de 2 a 10 años y la dependencia con respecto a un cuidador es cada vez mayor
- Etapa avanzada o terminal, caracterizada por un deterioro global y marcado de las funciones cognitivas, y en la que, en la mayoría de los casos, el enfermo es completamente dependiente. El paciente finaliza encamado, con alimentación asistida, con incontinencia urinaria y fecal, y síntomas como la rigidez muscular y la resistencia al cambio postural se agravan, pueden aparecer temblores e incluso crisis epilépticas. Por lo común, los enfermos con Alzheimer suelen fallecer por neumonía, infección viral u otro tipo de complicación.
El diagnóstico de la EA se establece clínicamente, debiéndose realizar una historia clínica completa, examen físico, examen cognitivo y en algunos casos un examen neuropsiquiátrico. Las causas reversibles de demencia se deben excluir mediante la detección de factores de riesgo modificables y la realización de pruebas complementarias.
El diagnóstico preciso de la EA requiere una historia detallada tanto del paciente con las personas familiarizadas con las actividades diarias del paciente, debiéndose indagar sobre:
- Antecedentes familiares de demencia.
- Pérdida de la memoria para eventos recientes y disfasia nominal (dificultades para encontrar las palabras y nombrarlas). Los pacientes también experimentan frecuentemente pérdida de memoria episódica que se caracteriza por ejemplo, por el olvido de los nombres de visitantes recientes, y la distorsion de la memoria con aparición de confabulación.
- Pérdida de las funciones ejecutivas y cognitivas, con dificultad en el razonamiento, la capacidad de abstracción y el juicio. La realización de tareas tales como las actividades de planificación, organización de eventos, la gestión del dinero se vuelve dificultosas, junto con la presencia de afasia apraxia y agnosia. A medida que la enfermedad progresa, los déficits en la función temporo-espacial se hacen evidentes. Características más raras, como la prosopagnosia (no reconocer caras familiares) y autoprosopagnosia (no reconocerse a uno mismo en el espejo) tienden a desarrollarse más tarde.
- Forma de inicio, duración, de la enfermedad, etc.
- Estado de ánimo del paciente, cambios en la personalidad y afectividad: trastornos conductuales como agresividad, apatía, desinhibición, paranoia, delirios, alucinaciones y depresión puede llegar a ser evidente.
- Anamnesis sobre el consumo de fármacos: Descartar exposición a tóxicos, metales pesados (plomo), alcohol, drogas, etc.
Evaluación de las funciones cognitivas
Se dispone de varias pruebas para evaluar las funciones cognitivas:
- Mini Mental State Examination de Folstein (MMSE): El MMSE evalúa las siguientes áreas: orientación, memoria, atención, capacidad para seguir ordenes orales y escritas, escritura espontánea y habilidades visuoconstructivas. Es el test cognitivo abreviado de mayor validez y difusión internacional. Su puntuación máxima es de 30 puntos y originariamente el valor límite o de corte se establecio en 24 puntos. Sin embargo, los resultados deben ser interpretados de acuerdo a diferentes criterios tales como la edad, el nivel educacional y otras variables personales. Se recomienda utilizar el valor límite de 26 puntos, valor utilizado en la mayoría de los estudios internacionales. Un resultado por debajo del valor límite sugiere deterioro cognitivo, pero un resultado considerado "normal" no lo descarta.
- Mini-Examen Cognoscitivo (MEC): Lobo y colaboradores en 1979 validaron el MMSE en población española, pero introduciendo cambios en algunos ítems que afectaban a la puntuación total, de modo que en lugar de obtenerse una puntuación total de 30 puntos, como sucedía con la versión original, se obtenían un máximo de 35 puntos. En personas mayores de 65 años el punto de corte se establece en 23/24 ( es decir, 23 puntos ó menos es igual a "caso" y 24 ó más a "no caso". Mas recientemente, Lobo et al. (1998) han validado una nueva versión del MEC conocida como Mini-Examen Cognoscitivo (MEC-30), en la que la puntuación máxima es de 30 puntos. Con un punto de corte establecido en 23/24, muestra unos coeficientes de validez similares a los obtenidos por Folstein et al. (1975): una sensibilidad del 89.9% y una especificidad del 75.1% .
- Escala de Blessed: valora la ejecución de hábitos y actividades de la vida diaria.
- Short Portable Mental Status Questionnaire (SPMSQ de Pfeiffer)
- Set-test de Isaacs
- Test del reloj
- Test de las fotos
- T@M (Test de Alteración de Memoria)
La exploración física suele ser normal al inicio de la enfermedad y según la enfermedad avanzada, los pacientes tienden a presentarse mal vestido, confusos, desorientados, con un paso lento, arrastrando los pies y postura encorvada. La enfermedad terminal se caracteriza por la rigidez y la incapacidad para caminar y hablar.
Exploraciones complementarias
Se deben excluir causas reversibles de demencia, debiéndose realizar de rutina: Hemograma, velocidad de sedimentación globular (VSG), bioquímica básica incluyendo pruebas de función hepática, renal, calcio, fosforo,sodio, potasio, hormona estimulante del tiroides (TSH), ANA, vitamina B12, acido fólico, y en pacientes con riesgo serología de sífilis (VDRL) y VIH .
Pruebas de imagen y otros estudios: La TAC y la RNM cerebral son de utilidad para excluir causas estructurales de demencia, permitiendo además evaluar la atrofia del hipocampo que apoyaría el diagnóstico de la EA. Otras pruebas de imagen como el PET y SPECT pueden ser útiles en casos atípicos. El análisis del LCR no se realiza rutinariamente en la evaluación de la EA (puede presentar una disminución del beta-amiloide y un incremento de la proteína tau), pero debe ser considerado cuando las características clínicas sugieren trastornos como el VIH, enfermedad de Lyme, infección por herpes o enfermedades por priones. Las pruebas genéticas se deberían realizar en la demencia de aparición temprana, o cuando se asocia a una fuerte historia familiar. El EEG rara vez se utiliza como una prueba de primera línea, aunque puede ser útil en el diagnostico diferencial de la enfermedad de Creutzfeld-Jacob (ECJ) que presenta un patrón característico.
Los criterios del National Institute on Aging y la Alzheimer's Association (NIA-AA) para la enfermedad de Alzheimer, publicados en 2011 y que sustituyen a los de 1984 del NINCDS-ADRDA (National Institute of Neurologic, Communicative Disorders and Stroke -Alzheimer's Disease and Related Disorders Association), son los más comúnmente utilizados para el diagnóstico de la enfermedad.
La principales características neuropatológicas de la EA son: Pérdida neuronal; Degeneración neurofibrilar (aglomeración de microtúbulos dentro de la neurona); Placas neuríticas (centro amiloideo, rodeado de axones y dendritas degenerados); Angiopatía amiloídea; Degeneración granulovacuolar.
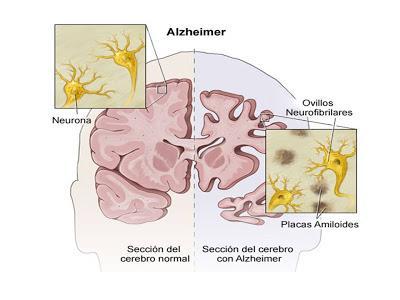
Estos cambios neuropatológicos se distribuyen ampliamente por la corteza cerebral, pero se concentran preferentemente en la zona medial de los lóbulos temporales e hipocampo, y la unión témporo-parieto-occipital y más tarde los lóbulos frontales también se comprometen.
En la EA, el neurotransmisor más comprometido es la acetilcolina. Se observa una disminución muy significativa en la actividad de la enzima acetilcolisnesterasa, enzima responsable de la síntesis de acetilcolina. También se ha observado depleción de noradrenalina, serotonina y somatostatina en los cerebros con EA.
El diagnóstico diferencial de la EA incluye:
- Demencia vascular: Es la segunda causa más frecuente de demencia. Es frecuente encontrar signos de focalización en el examen neurológico; antecedente de ACVA o TIA; antecedente de HTA, enfermedad cardíaca, arritmias, etc.
- Demencia fronto-temporal (Enfermedad de Pick): Se acompaña de cambios importantes en la personalidad, que aparecen precozmente en la evolución de la enfermedad. La función ejecutiva, es decir, la capacidad de planificar y realizar una acción están precozmente comprometidas. Característicamente hay desinhibición en el comportamiento y anosognosia, y por ello el paciente no se da cuenta de lo que le está pasando y niega los síntomas.
- Pseudodemencia depresiva: Es importante el antecedente de depresión en el pasado, y la historia familiar de problemas del ánimo. Hay humor depresivo y sentimientos de culpa o enfermedad. En caso de duda diagnóstica se recomienda dar tratamiento antidepresivo de prueba.
- Hidrocéfalia normotensiva: Precozmente aparece alteración de la marcha, luego incontinencia urinaria casi junto con el deterioro cognitivo (triada clásica). Aparece enlentecimiento psicomotor, deterioro de la concentración, y leve pérdida de memoria. Hay dilatación ventricular significativa en el TAC o RNM.
- Hematoma subdural o tumor cerebral: Buscar signos neurológicos focales, cefalea. Hallazgo en scanner o RNM.
- Encefalopatía VIH: Apatía, lentitud en el pensamiento; factores de riesgo de VIH; serología (+)
- Meningitis crónica: Déficit de atención, cefalea, enlentecimiento del pensamiento y movimientos, paresia de nervios craneanos.
- Enfermedad de Jakob- Creutzfeldt: Causada por priones. Curso rápidamente progresivo (1- 2 años), con signos piramidales y extrapiramidales, mioclonías, EEG con descargas en poliespigas periódicas. Es importante hacer un diagnóstico precoz, dado el mal pronóstico de la enfermedad y el riesgo de transmisión.
- Encefalopatía tóxica-metabólica: Déficit de atención, pensamiento y motilidad enlentecidos, enfermedad sistémica en curso. Historia de abuso de alcohol, drogas, o medicamentos-sedantes, hipnóticos, tranquilizantes, etc.
- Demencia por cuerpos de Lewy: Alteración cognitiva con enlentecimiento psicomotor, déficit en función ejecutiva y signos extrapiramidales (rigidez, temblor), junto con alucinaciones de aparicición precoz. Son hipersensibles a los neurolépticos, por lo que no deben utilizarse en estos pacientes.
El tratamiento y cuidado del paciente con EA requiere una coordinación multiprofesional entre médico, cuidador, familiares, trabajador social, psicólogo, etc. Existen algunos estudios que muestra que los medicamentos inhibidores de la colinesterasa y los antagonistas de los receptores NMDA, disminuyen o mejoran el deterioro cognitivo, pero en general no se dispone de evidencias sólidas sobre mejoraría en el pronostico de la enfermedad.
El tratamiento de la EA debe individualizarse, valorando los síntomas y la situación social. El primer paso tras el diagnóstico es proporcionar apoyo psicosocial, educación e información sobre los recursos sociosanitarios de apoyo tanto para el paciente como para la familia. Es importante hacer una evaluación actual y futura de aspectos relacionados con la seguridad en el hogar, riego de caídas, trasporte, necesidades de cuidados, testamento vital, ingreso en residencias, etc. La educación de la familia y derivación al trabajador social o a asociaciones como la asociación de Alzheimer, para conocer los recursos sociales con los que se cuenta, son de gran importancia.
Tratamiento no farmacológico
El tratamiento no-farmacológica comprende medidas como:
- Simplificar la comunicación verbal: Usar frases simples y cortas.
- Identificar y eliminar factores precipitantes de agitación y conductas agresivas: No confrontarlos tratando de llevarlos a la realidad, -solo se logra agitarlos o deprimirlos más-. Es preferible validar lo que afirman como verdad, y luego distraer su atención.
- Mantener una adecuada hidratación y nutrición.
- Minimizar el uso de medicamentos.
- Mantener un ambiente con buena iluminación, tranquilo y que les resulte familiar.
- Maximizar la seguridad en el entorno: Evitar desniveles, puertas de la calle abiertas, productos toxicos y medicamantos en lugares nseguros, etc.
- Asegurar un lugar protegido donde puedan moverse libremente pero sin peligro: Jardines con rutas circulares,
- Aromaterapia. Acuarios. Mascotas. Música. Mantener actividad física.
- En relación al cuidador, es importante el apoyo psicológico y social. Hasta el 30-40% de los cuidadores de pacientes con demencia desarrollan una depresión. Los grupos de autoayuda, para el cuidador y la familia son útiles para compartir experiencias y recibir apoyo.
Tratamiento farmacológico
El objetivo del tratamiento farmacológico de la EA es atenuar la sintomatología y enlentecer el deterioro cognitivo y funcional. Habitualmente se emplean inhibidores de la colinesterasa, antagonistas de los receptores de la N-metil D-aspartato (NMDA). También se emplean para los trastornos de conducta refractarios a intervenciones no farmacológicasn bajas dosis de antipsicóticos, antidepresivos y benzodiacepinas.
Inhibidores de la colinesterasa
El tratamiento con inhibidores de la colinesterasa está indicado en la EA leve-moderada - se ha demostrado en ensayos controlados con placebo que proporcionan una mejoría significativa de las funciones cognitivas en pacientes con EA leve-moderada, siendo las evidencias sobre la mejora de la calidad de vida menos ostensibles. La relación coste-beneficio sigue siendo controvertida, no disponiéndose de evidencias sobre el efecto en la enfermedad a largo plazo. Tampoco hay evidencias para recomendar el uso de estos fármacos en la EA grave. Las opciones disponibles son:
- Donepezilo: inicialmente 5 mg por vía oral /24 h, aumentando a 10 mg /24 h después de 4-6 semanas según la respuesta.
- Rivastigmina: inicialmente 1,5 mg /12 por vía oral, incrementando a intervalos quincenales en 1,5 mg dosis según respuesta y toxicidad hasta un máximo 12 mg / día
- Rivastigmina transdérmica: Inicialmente parches de 4,6 mg/24 horas, aumentando a parches de 9,5 mg/24 horas después de 4 semanas según la respuesta.Los pacientes en trato previo vía oral pueden pasar a la vía trasdérmica calculando el equivalente de la dosis ( 1,5-3 mg/12 h vo equivales a parche de 4,6 mg/24 h
- Galantamina: inicialmente 8 mg por vía oral (capsulas de liberación prolongada) una vez al día, aumentando en 8 mg /día cada 4 semanas si fuera preciso hasta un máximo de 24 mg / día
Entre los efectos secundarios de los inhibidores de la colinesterasa caben destacar: nauseas, vómitos diarrea, dolor abdominal, anorexia, astenia, cefalea, somnolencia, artromialgias, etc.
Antagonistas de los receptores de la N-metil D-aspartato (NMDA)
La memantina es un antagonista de la NMDA. Está indicada cuando los inhibidores de la colinesterasa no se toleran, resultan ineficaces o en el tratamiento de formas graves-severas de EA, -es bien tolerada y capaz de producir ligera mejoría de algunos síntomas (delirio, irritabilidad/labilidad, mejora del apetito/cambios de alimentación, depresión/disforia) en pacientes con EA moderada-severa-. Se administra a dosis inicialmente de 5 mg por vía oral /24 h, aumentando a 5 mg /12 h después de 1 semana, seguido de 10 mg por la mañana y 5 mg por la noche otra semana, y una dosis de mantenimiento de 10 mg/12 h. Puede utilizase sola o en combinación con inhibidores de la colinesterasa en la demencia severa. En la actualidad no se dispone de evidencias para recomendarla en el tratamiento de la EA leve.
Los inhibidores de colinesterasa y los antagonistas de los receptores NMDA, se debe suspender si hay efectos secundarios intolerables o si hay falta de cumplimiento debido problemas sociales, económicos o de otro tipo.
La depresión es muy común en el paciente con EA y tiene un impacto significativo sobre la función cognitiva. Los ISRS son los fármacos preferidos para en el tratamiento de la depresión que acompaña a la EA - la sertralina, citalopram, y escitalopram son los fármacos considerados de primera elección, debiéndose utilizar con precauciosn los ISRS de vida media larga (fluoxetina) y los que presentan mas frecuencia de interacciones (paroxetina)-.
La mirtazapina es un antidepresivo adecuado cuando los ISRS se muestran ineficaces y cuando la anorexia o el insomnio sean síntomas asociados a la depresión que interese tratar.
La trazodona ha demostrado ser un fármaco útil, en comparación con los antipsicoticos típicos como el haloperidol, para el tratamiento del paciente que presenta agitación, siendo también eficaz en el tratamiento del insomnio.
En todos los casos se deben emplear a dosis bajas, incrementándose gradualmente según la respuesta:
- Sertralina: 50-100 mg /24 h v.o
- Citalopram: 10-20 mg / 24 h v.o.
- Escitalopram: 10-20 mg / 24 h v.o.
- Mirtazapina: 15-45 mg / 24 h v.o.
- Trazodona: 50-200 mg/ 24 h v.o .
Antipsicóticos y otros fármacos en el tratamiento síntomas conductuales
Sigue siendo frecuente la utilización de de antipsicóticos a dosis bajas para el tratamiento de síntomas como la agitación, agresividad, alucinaciones, delirio, abandono del domicilio, etc. Sin embargo, el uso de antipsicoticos en pacientes con EA es cada vez más controvertido. Aunque algunos antipsicóticos, como la risperidona, han mostrado en algunos estudios cierta mejoría en los síntomas conductuales, hay evidencias cada vez más fuertes de que el empleo de antipsicóticos típicos y atípicos se asocia a un incremento en las tasas de mortalidad. Por lo que se recomienda agotar previamente todas las estrategias conductuales y psicosociales antes de indicarlos, de emplearlos hacerlo durante cortos periodos de tiempo, y evitar su utilización si existe cualquier sospecha de demencia vascular. Además los efectos secundarios extrapiramidales son más frecuentes con los antipsicóticos convencionales, y se debe hacer un estrecho seguimiento, debiéndose suspender el tratamiento si aparece algún síntoma neurológico, aumento de la confusión o disminución de la movilidad.
Como alternativa a los antipsicoticos se pueden utilizar benzodiacepinas de acción corta como el lorazepam, o estabilizadores del estado de ánimo, como la carbamazepina, una vez que las estrategias no farmacológicas destinadas a modificar el comportamiento han fracasadao. Las benzodiazepinas deben utilizarse con precaución, ya que pueden conducir a tolerancia, adicción y depresión y puede causar agitación paradójico en algunos casos. La trazodona también ha demostrado ser un agente útil para el tratamiento de la agitación asociada con la EA. Las dosis utilizadas de estos fármacos son:
- Carbamazepina: 100 mg por vía oral dos veces al día, máximo 300 mg / día
- Lorazepam: 0,5 mg por vía oral cuando se requiera.
- Trazodona: 50 mg por vía oral tres veces al día, máximo 600 mg / día
- Risperidona: 0,25 mg por vía oral dos veces al día
- Olanzapina: 2,5 mg por vía oral una vez al día
- Quetiapina: 12,5 mg por vía oral (liberación inmediata) dos veces al día
- Aripiprazol: 10 mg por vía oral una vez al día
- Haloperidol: 0,5 mg por vía oral dos veces al día
- Ziprasidona: 20 mg por vía oral dos veces al día
Los pacientes con EA experimentan con frecuencia insomnio. Las medidas de higiene del sueño, incluyendo una adecuada actividad durante el día, caminar a diario, evitar las siestas, etc., se ha demostrado que mejoran la calidad del sueño. El empleo de trazodona puede ser apropiado cuando otras intervenciones son ineficaces -Trazodona: 25-50 mg por vía oral una vez al día al acostarse, máximo 200 mg/día-.
Tratamientos farmacológicos ineficaces
Ni los AINE tradicionales ni los inhibidores de la COX-2 han demostrado efectos clínicamente significativo sobre los síntomas cognitivos o conductuales. Puede haber algún lugar para la aspirina, especialmente si la demencia es de tipo mixto. Sin embargo, existe una preocupación creciente por si el uso de aspirina pueda asociarse a un aumento del riesgo de hemorragia intracraneal en pacientes con EA. Tampoco hay evidencias concluyentes de que las estatinas, la vitamina E o el ginkgo biloba sean útiles en la prevención ni en el tratamiento de la EA.
La EA es una enfermedad crónica con un curso generalmente progresivo con algunas mesetas. Es común que al final la incapacidad sea total y la muerte ocurra, por lo general, a causa de una infección (neumonía por aspiración) o insuficiencia de otros sistemas del organismo.
Aunque no se dispone de claras evidencias muchos expertos recomiendan a las personas mayores mantenerse social, mental y físicamente activo como método para intentar prevenir o retrasar el desarrollo de demencia, fomentando el ejercicio físico, los hábitos alimenticios basados en la dieta mediterránea y controlando adecuadamente los factores de riesgo cardiovascular.
El entrenamiento cognitivo y la rehabilitación cognitiva son métodos que han despertado despiertan un gran interés. Su objetivo es ayudar a las personas con EA en estadio temprano para que aprovechen al máximo el funcionamiento de su memoria a pesar de las limitaciones que presentan. El entrenamiento cognitivo incluye la práctica guiada de un conjunto de tareas que estimulan las funciones cognitivas, como la memoria, la atención o la solución de problemas, que puede realizarse en una variedad de entornos y formatos. La rehabilitación cognitiva incluye la identificación de las maneras de satisfacer las necesidades individuales, mediante estrategias que incorporan información o métodos compensatorios como ayuda a la utilización de la memoria.
Aunque hay varios informes que indican que estos abordajes puede ser útiles, los resultados de un número limitado de ensayos controlados aleatorios no proporcionaron pruebas acerca de un beneficio significativo del entrenamiento cognitivo, y no existen hasta el momento ensayos controlados aleatorios de rehabilitación cognitiva para las personas con demencia y no es posible llegar a una conclusión acerca de la efectividad de este abordaje.
No hay evidencia suficiente para recomendar la realización sistemática de pruebas de cribado de demencia en población asintomática. Tampoco las pruebas de cribado de deterioro cognitivo leve (DCL) que existen en la actualidad permiten una detección eficaz del DCL, aunque el test del Saint Louis University Mental Status (SLUMS) es mas sensible para detectar DCL que el MMSE. En consecuencia se recomienda estar alerta ante síntomas de alarma de demencias como pérdida de memoria, deterioro funcional o trastornos de comportamiento, referidos por la familia o el propio paciente, y ante la sospecha o evidencia de deterioro cognitivo se recomienda una evaluación clínica detallada que incluya entrevista clínica estructurada y tests neuropsicológicos, y un seguimiento posterior individualizado para evaluar su progresión.
- American Academy of Neurology. Practice parameters: detection, diagnosis and management of dementia. 2001. Disponbible en: http://www.aan.com
- American Psychiatric Association. Diagnostic and statistical manual of mental disorders, 4th ed., text revised (DSM-IV-TR). Washington, DC: 2000.
- Andersen K, Launer LJ, Ott A, et al. Do nonsteroidal anti-inflammatory drugs decrease the risk for Alzheimer's disease? The Rotterdam Study. Neurology. 1995;45:1441-1445.
- Andreasen N, Minthon L, Clarberg A, et al. Sensitivity, specificity, and stability of CSF-tau in AD in a community-based patient sample. Neurology. 1999;53:1488-1494.
- Areosa SA, Sherriff F, McShane R. Memantine for dementia. Cochrane Database Syst Rev. 2005(3):CD003154.
- Aronson S, Van Baelen B, Kavanagh S, et al. Optimal dosing of galantamine in patients with mild or moderate Alzheimer's disease: post hoc analysis of a randomized, double-blind, placebo-controlled trial. Drugs Aging. 2009;26:231-239.
- Farlow MRS, Salloway S, Tariot PN, et al. Effectiveness and tolerability of high-dose (23 mg/d) versus standard-dose (10 mg/d) donepezil in moderate to severe Alzheimer's disease: a 24-week, randomized, double-blind study. Clin Ther. 2010;32:1234-1251.
- Ayalon L, Gum AM, Feliciano L, et al. Effectiveness of nonpharmacological interventions for the management of neuropsychiatric symptoms in patients with dementia: a systematic review. Arch Intern Med. 2006;166:2182-2188.
- Bachman DL, Wolf PA, Linn R, et al. Prevalence of dementia and probable senile dementia of the Alzheimer type in the Framingham Study. Neurology. 1992;42:115-119.
- Bachman DL, Wolf PA, Linn RT, et al. Incidence of dementia and probable Alzheimer's disease in a general population: the Framingham Study. Neurology. 1993;43:515-519.
- Birks J, Grimley Evans J, Iakovidou V, et al. Rivastigmine for Alzheimer's disease. Cochrane Database Syst Rev. 2009(2):CD001191.
- Birks J. Cholinesterase inhibitors for Alzheimer's disease. Cochrane Database Syst Rev. 2006;(1):CD005593.
- Birks JF, Flicker L. Donepezil for mild cognitive impairment. Cochrane Database Syst Rev. 2009;(3):CD006104.
- Blesa R, Ballard C, Orgogozo JM, et al. Caregiver preference for rivastigmine patches versus capsules for the treatment of Alzheimer disease. Neurology. 2007;69:S23-S28.
- Briel RC, McKeith IG, Barker WA, et al. EEG findings in dementia with Lewy bodies and Alzheimer's disease. J Neurol Neurosurg Psychiatry. 1999;66:401-403.
- Burgunder JM, Finsterer J, Szolnoki Z, et al. EFNS guidelines on the molecular diagnosis of channelopathies, epilepsies, migraine, stroke, and dementias. Eur J Neurol. 2010;17:641-648.
- Chetelat G, Baron JC. Early diagnosis of Alzheimer's disease: contribution of structural neuroimaging. Neuroimage. 2003;18:525-541.
- Clare L, Woods RT, Moniz Cook ED, et al. Cognitive rehabilitation and cognitive training for early-stage Alzheimer's disease and vascular dementia. Cochrane Database Syst Rev. 2003(4):CD003260.
- Claus JJ, van Harskamp F, Breteler MM, et al. The diagnostic value of SPECT with Tc 99m HMPAO in Alzheimer's disease: a population-based study. Neurology. 1994;44:454-461.
- Corey-Bloom J. The natural history of Alzheimer's disease. In: O'Brien J, Ames D, Burns A, eds. Dementia. 2nd ed. London: Arnold; 2000:405-415.
- Courtney C, Farrell D, Gray R, et al. Long-term donepezil treatment in 565 patients with Alzheimer's disease (AD2000): randomised double-blind trial. Lancet. 2004;363:2105-2115.
- Dal Forno G, Palermo MT, Donohue JE, et al. Depressive symptoms, sex, and risk for Alzheimer's disease. Ann Neurol. 2005;57:381-387.
- Darreh-Shori T, Jelic V. Safety and tolerability of transdermal and oral rivastigmine in Alzheimer's disease and Parkinson's disease dementia. Expert Opin Drug Saf. 2010;9:167-176.
- DeKosky ST, Williamson JD, Fitzpatrick AL, et al. Ginkgo biloba for prevention of dementia: a randomized controlled trial. JAMA. 2008;300:2253-2262.
- Desilets ARK. The role of statins in the prevention and treatment of Alzheimer's disease. J Pharm Technology. 2010;26:276-284.
- Egan MB, Bérubé D, Racine G, et al. Methods to enhance verbal communication between individuals with Alzheimer's disease and their formal and informal caregivers: a systematic review. Int J Alzheimers Dis. 2010;906818.
- Etminan M, Gill S, Samii A. Effect of non-steroidal anti-inflammatory drugs on risk of Alzheimer's disease: systematic review and meta-analysis of observational studies. BMJ. 2003;327:128.
- Evans DA, Funkenstein HH, Albert MS, et al. Prevalence of Alzheimer's disease in a community population. Higher than previously reported. JAMA. 1989;262:2551-2556.
- Feldman HH, Doody RS, Kivipelto M, et al. Randomized controlled trial of atorvastatin in mild to moderate Alzheimer disease: LEADe. Neurology. 2010;74:956-964.
- Ferri CP, Prince M, Brayne C, et al. Global prevalence of dementia: a Delphi consensus study. Lancet. 2005;366:2112-2117.
- Flood JF, Morley JE, Lanthorn TH. Effect on memory processing by D-cycloserine, an agonist of the NMDA/glycine receptor. Eur J Pharmacol. 1992;221:249-254.
- Freund-Levi Y, Eriksdotter-Jonhagen M, Cederholm T, et al. Omega-3 fatty acid treatment in 174 patients with mild to moderate Alzheimer disease: OmegAD study: a randomized double-blind trial. Arch Neurol. 2006;63:1402-1408.
- Geldmacher DS, Provenzano G, McRae T, et al. Donepezil is associated with delayed nursing home placement in patients with Alzheimer's disease. J Am Geriatr Soc. 2003;51:937-944.
- Gilman S, Koller M, Black RS, et al. Clinical effects of Abeta immunization (AN1792) in patients with AD in an interrupted trial. Neurology. 2005;64:1553-1562.
- Gold MA, Alderton C, Zvartau-Hind M, et al. Rosiglitazone monotherapy in mild-to-moderate alzheimer's disease: results from a randomized, double-blind, placebo-controlled phase III study. Dement Geriatr Cogn Dis. 2010;30:131-146.
- Graff MJ, Adang EM, Vernooij-Dassen MJ, et al. Community occupational therapy for older patients with dementia and their care givers: cost effectiveness study. BMJ. 2008;336:134-138.
- Graff MJ, Vernooij-Dassen MJ, Thijssen M, et al. Effects of community occupational therapy on quality of life, mood, and health status in dementia patients and their caregivers: a randomized controlled trial. J Gerontol A Biol Sci Med Sci. 2007;62:1002-1009.
- Grossberg GS, Sadowsky C, Olin JT. Rivastigmine transdermal system for the treatment of mild to moderate Alzheimer's disease. Int J Clin Practice. 2010;64:651-660.
- Grossman H, Bergmann C, Parker S. Dementia: a brief review. Mt Sinai J Med. 2006;73:985-992.
- Guy M. McKhann, David S. Knopman, Howard Chertkow, Bradley T. Hyman, Clifford R. Jack, Claudia H. Kawas et ál. The diagnosis of dementia due to Alzheimer's disease: recommendations from the National Institute on Aging and the Alzheimer's Association workgroup. Alzheimer's and Dementia 2011; doi: 10.1016/j.jalz.2011.03.005.
- Hebert LE, Scherr PA, Bienias JL, et al. Alzheimer disease in the US population: prevalence estimates using the 2000 census. Arch Neurol. 2003;60:1119-1122.
- Hogervorst E, Yaffe K, Richards M, et al. Hormone replacement therapy to maintain cognitive function in women with dementia. In: Cochrane Database Syst Rev. 2002(3):CD003799.
- Hort JO, O'Brien JT, Gainotti G, et al. EFNS guidelines for the diagnosis and management of Alzheimer's disease. Eur J Neurol. 2010;17:1236-1248.
- Huang Y. Apolipoprotein E and Alzheimer disease. Neurology. 2006;66:S79-S85.
- Hulme CW, Wright J, Crocker T, et al. Non-pharmacological approaches for dementia that informal carers might try or access: a systematic review. Int J Geriatr Psychiatry. 2010;25:756-763.
- Ihl R, Frölich L, Winblad B, et al. World Federation of Societies of Biological Psychiatry (WFSBP) guidelines for the biological treatment of Alzheimer's disease and other dementias. World J Biol Psychiatry. 2011;12:2-32.
- Ihl RT, Tribanek M, Bachinskaya N. Baseline neuropsychiatric symptoms are effect modifiers in Ginkgo biloba extract (EGb 761) treatment of dementia with neuropsychiatric features: retrospective data analyses of a randomized controlled trial. J Neurol Sci. 2010;299:184-187.
- Isaac M, Quinn R, Tabet N. Vitamin E for Alzheimer's disease and mild cognitive impairment. Cochrane Database Syst Rev. 2008(3):CD002854.
- Iverson DJ, Gronseth GS, Reger MA, et al. Practice parameter update: evaluation and management of driving risk in dementia: report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology. 2010;74:1316-1324.
- Jellinger KA, Paulus W, Wrocklage C, et al. Traumatic brain injury as a risk factor for Alzheimer disease. Comparison of two retrospective autopsy cohorts with evaluation of ApoE genotype. BMC Neurol. 2001;1:3.
- Jones RW. A review comparing the safety and tolerability of memantine with the acetylcholinesterase inhibitors. Int J Geriatr Psychiatry. 2010;25:547-553.
- Kales HC, Valenstein M, Kim HM, et al. Mortality risk in patients with dementia treated with antipsychotics versus other psychiatric medications. Am J Psychiatry. 2007;164:1568-1576.
- Katz I, de Deyn PP, Mintzer J, et al. The efficacy and safety of risperidone in the treatment of psychosis of Alzheimer's disease and mixed dementia: a meta-analysis of 4 placebo-controlled clinical trials. Int J Geriatr Psychiatry. 2007;22:475-484.
- Kawas C, Resnick S, Morrison A, et al. A prospective study of estrogen replacement therapy and the risk of developing Alzheimer's disease: the Baltimore Longitudinal Study of Aging. Neurology. 1997;48:1517-1521.
- Kelley BJ, Petersen RC. Alzheimer's disease and mild cognitive impairment. Neurol Clin. 2007;25:577-609.
- Larson EB, Wang L, Bowen JD, et al. Exercise is associated with reduced risk for incident dementia among persons 65 years of age and older. Ann Intern Med. 2006;144:73-81.
- Lautenschlager NT, Cupples LA, Rao VS, et al. Risk of dementia among relatives of Alzheimer's disease patients in the MIRAGE study: what is in store for the oldest old? Neurology. 1996;46;641-650.
- Lee Y, Back JH, Kim J, et al. Systematic review of health behavioral risks and cognitive health in older adults. Int Psychogeriatr. 2010;22:174-187.
- Lobo A, Launer LJ, Fratiglioni L, et al; Neurologic Diseases in the Elderly Research Group. Prevalence of dementia and major subtypes in Europe: a collaborative study of population-based cohorts. Neurology. 2000;54:S4-S9.
- Lyketsos CG, DelCampo L, Steinberg M, et al. Treating depression in Alzheimer disease: efficacy and safety of sertraline therapy, and the benefits of depression reduction: the DIADS. Arch Gen Psychiatry. 2003;60:737-746.
- Mazza M, Capuano A, Bria P, et al. Ginkgo biloba and donepezil: a comparison in the treatment of Alzheimer's dementia in a randomized placebo-controlled double-blind study. Eur J Neurol. 2006;13:981-985.
- McCaddon A, Hudson P, Davies G, et al. Homocysteine and cognitive decline in healthy elderly. Dement Geriatr Cogn Disord. 2001;12:309-313.
- McCurry SM, Gibbons LE, Logsdon RG, et al. Nighttime insomnia treatment and education for Alzheimer's disease: a randomized, controlled trial. J Am Geriatr Soc. 2005;53:793-802.
- McGuinness B, O'Hare J, Craig D, et al. Statins for the treatment of dementia. Cochrane Database Syst Rev. 2010;(8):CD007514.
- McKhann G, Drachman D, Folstein M, et al. Clinical diagnosis of Alzheimer's disease: report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer's Disease. Neurology. 1984;34:939-944.
- McKhann GM, Knopman DS, Chertkow H, et al. The diagnosis of dementia due to Alzheimer's disease: recommendations from the National Institute on Aging-Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease. Alzheimers Dement. 2011;7:263-269.
- Mecocci P, Bladström A, Stender K. Effects of memantine on cognition in patients with moderate to severe Alzheimer's disease: post-hoc analyses of ADAS-cog and SIB total and single-item scores from six randomized, double-blind, placebo-controlled studies. Int J Geriatr Psychiatry. 2009;24:532-538.
- Mitchell AJ. CSF phosphorylated tau in the diagnosis and prognosis of mild cognitive impairment and Alzheimer's disease: a meta-analysis of 51 studies. J Neurol Neurosurg Psychiatry. 2009;80:966-975.
- Mittelman MS, Haley WE, Clay OJ, et al. Improving caregiver well-being delays nursing home placement of patients with Alzheimer disease. Neurology. 2006;67:1592-1599.
- Mora Simón S, García García R, Perea Bartolomé MV, Ladera Fernández V, Unzueta Arce J, Patino Alonso MC, Rodríguez Sánchez E. Deterioro cognitivo leve: Detección temprana y nuevas perspectivas. Rev Neurol 2012; 54 (5): 303-310.
- Myers RH, Schaefer EJ, Wilson PW, et al. Apolipoprotein E epsilon4 association with dementia in a population-based study: the Framingham study. Neurology. 1996;46:673-677.
- National Institute for Health and Clinical Excellence. Donepezil, galantamine, rivastigmine and memantine for the treatment of Alzheimer's disease. March 2011. Disponible en: www.nice.org.uk/guidance/TA217
- Neal M, Briggs M, et al. Validation therapy for dementia. Cochrane Database Syst Rev. 2003(3):CD001394.
- Nunomura A, Perry G, Aliev G, et al. Oxidative damage is the earliest event in Alzheimer disease. J Neuropathol Exp Neurol. 2001;60:759-767.
- Petersen RC, Thomas RG, Grundman M, et al. Vitamin E and donepezil for the treatment of mild cognitive impairment. N Engl J Med. 2005;352:2379-2388.
- Qiu C, De Ronchi D, Fratiglioni L. The epidemiology of the dementias: an update. Curr Opin Psychiatry. 2007;20:380-385.
- Quinn JF, Raman R, Thomas RG, et al. Docosahexaenoic acid supplementation and cognitive decline in Alzheimer disease: a randomized trial. JAMA. 2010;304:1903-1911.
- Reisberg B, Doody R, Stoffler A, et al. A 24-week open-label extension study of memantine in moderate to severe Alzheimer disease. Arch Neurol. 2006;63:49-54.
- Romas SN, Tang MX, Berglund L, et al. ApoE genotype, plasma lipids, lipoproteins, and AD in community elderly. Neurology. 1999;53:517-521.
- Sadowsky CH, Dengiz A, Olin JT, et al. Switching from donepezil tablets to rivastigmine transdermal patch in Alzheimer's disease. Am J Alzheimers Dis Other Demen. 2009;24:267-275.
- Scheltens P, Fox N, Barkhof F, et al. Structural magnetic resonance imaging in the practical assessment of dementia: beyond exclusion. Lancet Neurol. 2002;1:13-21.
- Seshadri S. Elevated plasma homocysteine levels: risk factor or risk marker for the development of dementia and Alzheimer's disease? J Alzheimers Dis. 2006;9:393-398.
- Small G, Dubois B. A review of compliance to treatment in Alzheimer's disease: potential benefits of a transdermal patch. Curr Med Res Opin. 2007;23:2705-2713.
- Sparks DL, Connor DJ, Sabbagh MN, et al. Circulating cholesterol levels, apolipoprotein E genotype and dementia severity influence the benefit of atorvastatin treatment in Alzheimer's disease: results of the Alzheimer's Disease Cholesterol-Lowering treatment (ADCLT) trial. Acta Neurol Scand Suppl. 2006;185:3-7.
- Staffen W, Schonauer U, Zauner H, et al. Brain perfusion SPECT in patients with mild cognitive impairment and Alzheimer's disease: comparison of a semiquantitative and a visual evaluation. J Neural Transm. 2006;113:195-203.
- Streit WJ. Microglia and Alzheimer's disease pathogenesis. J Neurosci Res. 20041;77:1-8.
- Sultzer DL, Gray KF, Gunay I, et al. A double-blind comparison of trazodone and haloperidol for treatment of agitation in patients with dementia. Am J Geriatr Psychiatry. 1997;5:60-69.
- Tabet N, Feldman H. Indomethacin for Alzheimer's disease. Cochrane Database Syst Rev. 2002(2):CD003673.
- Tabet N, Feldmand H. Ibuprofen for Alzheimer's disease. Cochrane Database Syst Rev. 2003(2):CD004031.
- Tang MX, Jacobs D, Stern Y, et al. Effect of oestrogen during menopause on risk and age at onset of Alzheimer's disease. Lancet. 1996;348:429-432.
- Tariot PN, Erb R, Podgorski CA, et al. Efficacy and tolerability of carbamazepine for agitation and aggression in dementia. Am J Psychiatry. 1998;155:54-61.
- Tariot PN, Farlow MR, Grossberg GT, et al. Memantine treatment in patients with moderate to severe Alzheimer disease already receiving donepezil: a randomized controlled trial. JAMA. 2004;291:317-324.
- Tariq SH, Tumosa N, Chibnall JT, et al. Comparison of the Saint Louis University mental status examination and the Mini-Mental State Examination for detecting dementia and mild neurocognitive disorder--a pilot study. Am J Geriatr Psychiatry. 2006;14:900-910.
- Teri L, Gibbons LE; McCurry SM, et al. Exercise plus behavioral management in patients with Alzheimer disease: a randomized controlled trial. JAMA. 2003;290:2015-2022.
- Thoonsen H, Richard E, Bentham P, et al. Aspirin in Alzheimer's disease: increased risk of intracerebral hemorrhage: cause for concern? Stroke. 2010;41:2690-2692.
- Trinh NH, Hoblyn J, Mohanty S, et al. Efficacy of cholinesterase inhibitors in the treatment of neuropsychiatric symptoms and functional impairment in Alzheimer disease: a meta-analysis. JAMA. 2003;289:210-216.
- van Rossum IA, Vos S, Handels R, et al. Biomarkers as predictors for conversion from mild cognitive impairment to Alzheimer-type dementia: implications for trial design. J Alzheimers Dis. 2010;20:881-891.
- Wang PS, Schneeweiss S, Avorn J, et al. Risk of death in elderly users of conventional vs. atypical antipsychotic medications. N Engl J Med. 2005;353:2335-2341.
- Warner J, Butler R, Gupta S. Dementia. BMJ Clinical Evid. April 2010. Disponible en: http://clinicalevidence.bmj.com
- Watkins PB, Zimmerman HJ, Knapp MJ, et al. Hepatotoxic effects of tacrine administration in patients with Alzheimer's disease. JAMA. 1994;271:992-998.
- Weinmann S, Roll S, Schwarzbach C, et al. Effects of Ginkgo biloba in dementia: systematic review and meta-analysis. BMC Geriatr. 2010;10:14.
- Winblad B, Grossberg G, Frolich L, et al. IDEAL: a 6-month, double-blind, placebo-controlled study of the first skin patch for Alzheimer disease. Neurology. 2007;69:S14-S22.
- Winblad B, Wimo A, Engedal K, et al. 3- year study of donepezil therapy in Alzheimer's disease: effects of early and continuous therapy. Dement Geriatr Cogn Disord. 2006;21:353-363.
- Yatham LN, McHale PA, Kinsella A. Down's syndrome and its association with Alzheimer's disease. Acta Psychiatr Scand. 1988;77:38-41.
- Yesavage JA, Brink TL, Rose TL, et al. Development and validation of a geriatric depression screening scale: a preliminary report. J Psychiatr Res. 1982;17:37-49.
- Zhou B, Teramukai S, Fukushima M. Prevention and treatment of dementia or Alzheimer's disease by statins: a meta-analysis. Dement Geriatr Cogn Disord. 2007;23:194-201.
